通过机器学习加快药物发现
药物只有在坚持体内的靶蛋白时才能发挥作用。评估粘性是药物发现和筛选过程中的一个关键障碍。结合化学和机器学习的新研究可以降低这一障碍。
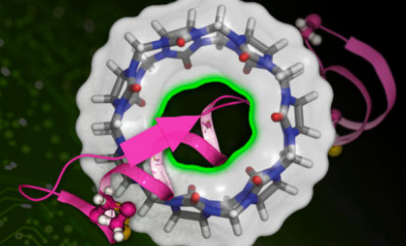
这项名为 DeepBAR 的新技术可以快速计算候选药物与其靶标之间的结合亲和力。与以前最先进的方法相比,该方法在很短的时间内产生精确的计算。研究人员表示,DeepBAR 有朝一日可以加快药物发现和蛋白质工程的步伐。
麻省理工学院的研究人员开发了一种基于机器学习的技术,可以更快地计算药物分子(以粉红色表示)与目标蛋白(圆形结构)的结合亲和力。图片来源:麻省理工学院新闻,圆形结构由研究人员提供
“我们的方法比以前快了几个数量级,这意味着我们可以发现既有效又可靠的药物,”麻省理工学院博德研究所准成员、辉瑞劳巴赫化学职业发展教授 Bin Zhang 说和哈佛大学,以及一篇描述该技术的新论文的合著者。
该研究发表在《物理化学快报》上。该研究的主要作者是麻省理工学院化学系的博士后丁新强。
药物分子和靶蛋白之间的亲和力通过称为结合自由能的数量来衡量——数字越小,结合越粘。“较低的结合自由能意味着药物可以更好地与其他分子竞争,”张说,“这意味着它可以更有效地破坏蛋白质的正常功能。” 计算候选药物的结合自由能提供了药物潜在有效性的指标。但这是一个难以确定的数量。
计算结合自由能的方法分为两大类,每一类都有自己的缺点。一类是精确计算数量,消耗大量时间和计算机资源。第二类计算成本较低,但它仅产生结合自由能的近似值。张和丁设计了一种方法来两全其美。
准确高效
DeepBAR 精确计算结合自由能,但它只需要以前方法所需计算的一小部分。新技术将传统的化学计算与机器学习的最新进展相结合。
DeepBAR 中的“BAR”代表“贝内特接受率”,这是一种已有数十年历史的算法,用于精确计算结合自由能。使用 Bennet 接受率通常需要了解两个“终点”状态(例如,与蛋白质结合的药物分子和与蛋白质完全分离的药物分子),以及许多中间状态的知识(例如,不同水平的部分结合),所有这些都会降低计算速度。
DeepBAR 通过在称为深度生成模型的机器学习框架中部署 Bennett 接受率来削减那些中间状态。“这些模型为每个端点、绑定状态和未绑定状态创建了一个参考状态,”张说。这两个参考状态足够相似,可以直接使用 Bennett 接受率,无需所有昂贵的中间步骤。
在使用深度生成模型时,研究人员借鉴了计算机视觉领域。“它基本上与人们用来进行计算机图像合成的模型相同,”张说。“我们将每个分子结构视为图像,模型可以学习。因此,这个项目建立在机器学习社区的努力之上。”
虽然将计算机视觉方法应用于化学是 DeepBAR 的关键创新,但这种交叉也带来了一些挑战。“这些模型最初是为 2D 图像开发的,”丁说。“但在这里我们有蛋白质和分子——它真的是一个 3D 结构。因此,在我们的案例中采用这些方法是我们必须克服的最大技术挑战。”
在使用类似蛋白质的小分子的测试中,DeepBAR 计算结合自由能的速度比以前的方法快近 50 倍。张说,效率意味着“我们真的可以开始考虑用它来进行药物筛选,特别是在 Covid 的背景下。DeepBAR 的准确度与黄金标准完全相同,但速度要快得多。” 研究人员补充说,除了药物筛选外,DeepBAR 还可以帮助蛋白质设计和工程,因为该方法可用于模拟多种蛋白质之间的相互作用。
加州大学圣地亚哥分校药物科学教授迈克尔吉尔森说,DeepBAR 是“一项非常好的计算工作”,在将其用于现实世界的药物发现之前还有一些障碍需要清除,他没有参与其中。这个调查。他说 DeepBAR 需要根据复杂的实验数据进行验证。“这肯定会带来更多的挑战,并且可能需要增加更多的近似值。”
未来,研究人员计划提高 DeepBAR 运行大型蛋白质计算的能力,计算机科学的最新进展使这项任务变得可行。“这项研究是将几十年来发展起来的传统计算化学方法与机器学习的最新发展相结合的一个例子,”丁说。“所以,我们实现了以前不可能实现的目标。”
标签:
